 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free! Get your ComboX free sample to test now!
Get your ComboX free sample to test now!
 Time Limited Offer: Welcome Gift for New Customers !
Time Limited Offer: Welcome Gift for New Customers !  Shipping Price Reduction for EU Regions
Shipping Price Reduction for EU Regions
> Multi-Pass-Transmembranproteine und Technologieplattformen
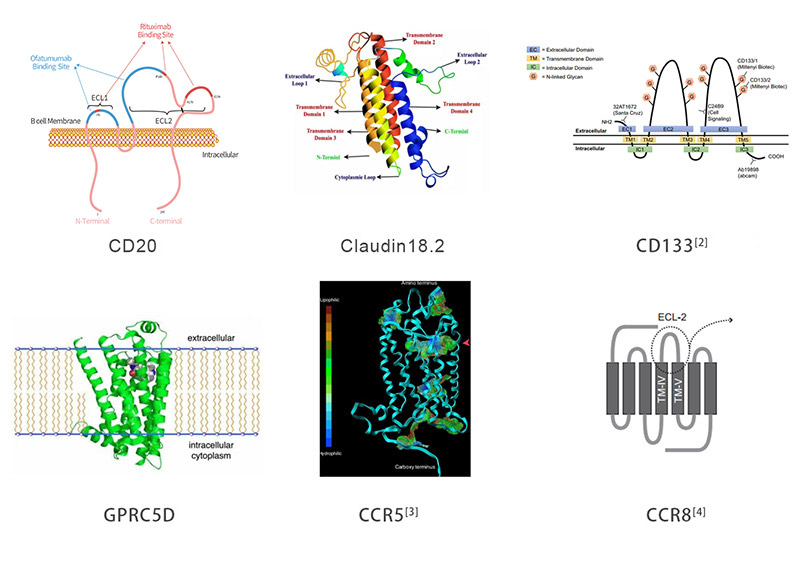
Die auf dem HEK293-Expressionssystem basierende Technologieplattform VLP (Virus like Particles/virusähnliche Partikel) wurde von ACROBiosystems speziell für die Expression von TPs auf der Wirtszelloberfläche eingerichtet. Das Virushüllen-/Kapsidprotein wandelt diese Zelloberflächen dann in lösliche Lipiddoppelschichtpartikel mit hochkonzentrierten Proteinen um, die für Antikörperimmunisierung und -screening zugänglich sind. Der Membranprotein-VLP-Komplex zeigt korrekt gefaltete Multi-Pass-TPs in seiner Zellmembran wodurch man funktionelle Antikörper induzieren und filtern kann, die die natürliche Konformation des Ziels erkennen. Neben unserem Katalog von VLP-basierten Multi-Pass-TPs bietet ACRO auch kundenspezifische Dienstleistungen an.
Die Transmembranregion von Multi-Pass-TPs ist stark hydrophob und somit ist es schwierig, die korrekte Konformation in üblichen Puffern aufrechtzuerhalten, sobald sie aus der Zellmembran extrahiert wurden. Dieses Problem kann durch Zugabe von Detergenzien gelöst werden. ACROBiosystems hat eine vollständige Plattform für die Expression, Reinigung und Stabilisierung von schwierigen Wirkstoff-Target-TPs in Insekten- und Säugetierzellen entwickelt. ACRO führt Detergensscreening einschließlich DDM/CHS (Kat. Nr. DC-11) durch, um die Löslichkeit zu erhöhen und die ursprüngliche Faltung dieses Proteins in vitro sicherzustellen.
"Nanodisc" ist eine synthetische Phospholipid-Doppelschicht-Membranstruktur, die aus Membrangerüstproteinen (MSPs) und Phospholipidmolekülen besteht. TP kann nach Entfernung des Detergens in die spezielle Struktur von Nanodisc integriert werden, so dass es seine ursprüngliche Faltung beibehalten, seine biologische Aktivität bewahren und eine verbesserte Hydrophilie für eine Vielzahl von Anwendungen zeigen kann. Beispielsweise ist die detergenzfreie Zusammenstellung von Nanodisc-basiertem TP in CAR-Expressionstests kompatibel. ACROBiosystems den Fertigungsprozess kontinuierlich optimiert und verbessert, um eine industrielle Serienfertigung zu ermöglichen. Die Bemühungen von ACRO haben eine langfristig stabile Versorgung mit Nanodisc-basierten TP-Produkten für die biopharmazeutische Industrie sichergestellt.
VLP
Detergenzmizellen
Nanodisc
| Molecule | Cat. No. | Product Description | Application | Preorder/Order |
|---|
| Molecule | Cat. No. | Product Description | Application | Preorder/Order |
|---|
| Molecule | Cat. No. | Product Description | Application | Preorder/Order |
|---|
Die folgenden SPR-Verfahrensanweisungen sind kostenlos verfügbar.
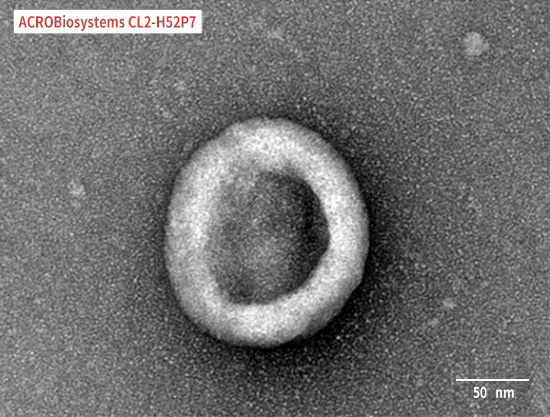
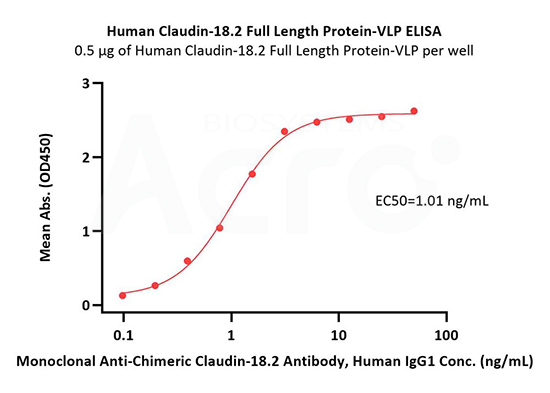
Immobilized Human Claudin-18.2 Full Length Protein-VLP (Cat. No. CL2-H52P7) at 5 μg/mL (100 μL/well) can bind Monoclonal Anti-Chimeric Claudin-18.2 Antibody, Human IgG1 with a linear range of 0.2-3 ng/mL (QC tested).
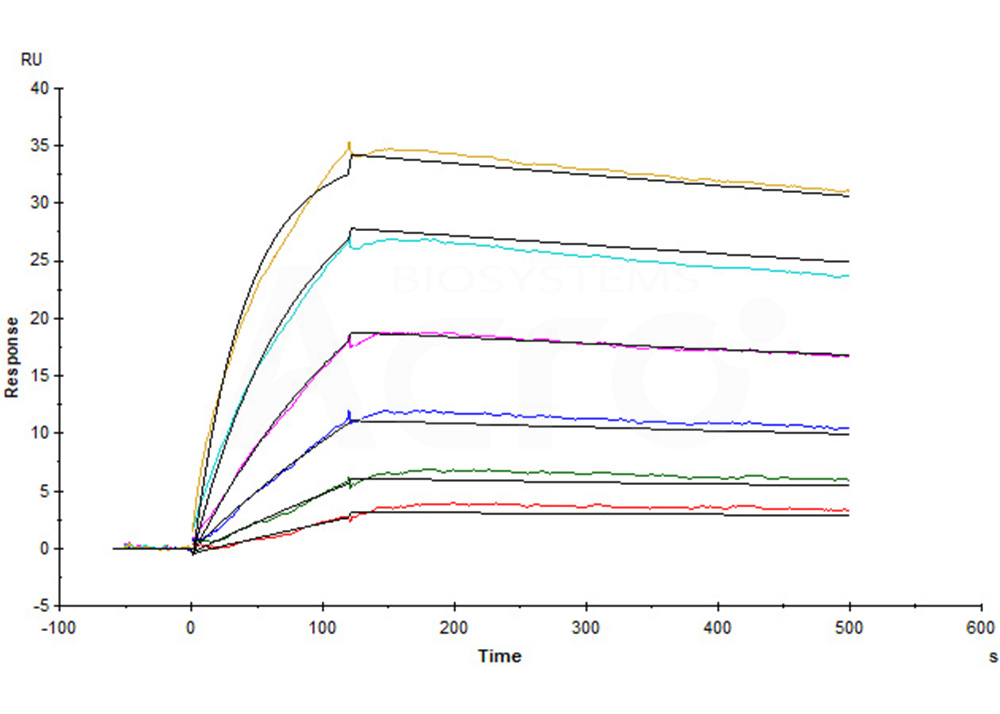
Human Claudin-18.2 Full Length Protein-VLP (Cat. No. CL2-H52P7) captured on CM5 Chip via Anti-Claudin-18.2 antibody can bind Anti-Claudin-18.2 antibody with an affinity constant of 0.374 nM as determined in a SPR assay (Biacore T200) (Routinely tested).
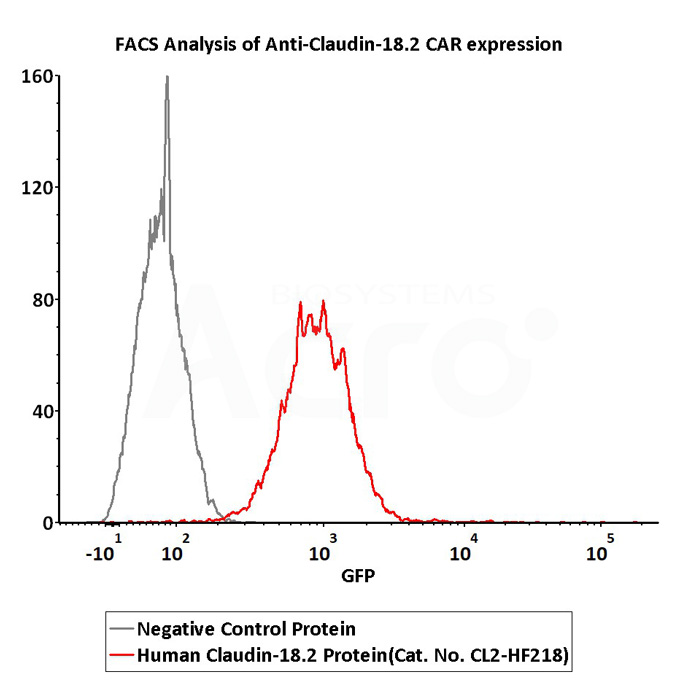
2e5 of Anti-Claudin-18.2 CAR-293 cells were stained with 100 μL of 3 μg/mL of Fluorescent Human Claudin-18.2 Full Length Protein-VLP (Cat. No.CL2-HF218) and negative control protein respectively, FITC signals was used to evaluate the binding activity (QC tested).
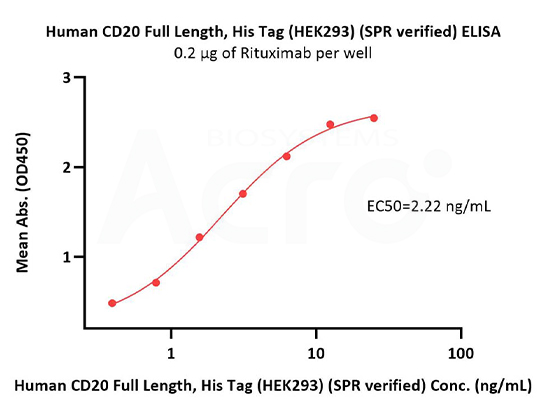
Immobilized Rituximab at 2 μg/mL (100 μL/well) can bind Human CD20 Full Length Protein, His Tag (Cat. No. CD0-H52H3) with a linear range of 0.4-3 ng/mL (in presence of DDM and CHS) (QC tested).
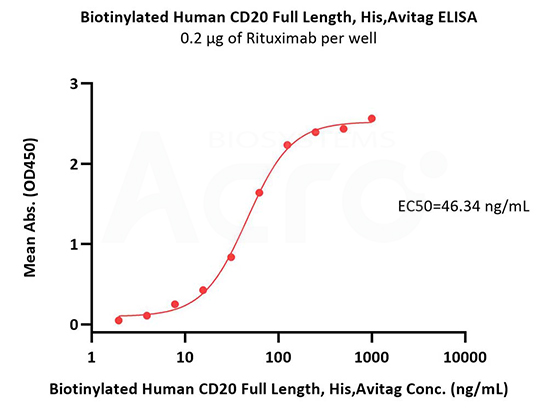
Immobilized Rituximab at 2 μg/mL (100 μL/well) can bind Biotinylated Human CD20 Full Length, His,Avitag (Cat. No. CD0-H82E5) with a linear range of 4-63 ng/mL (in presence of DDM and CHS) (QC tested).
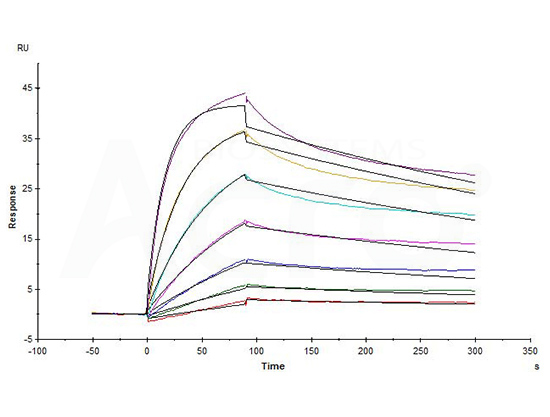
Biotinylated Human CD20 Full Length, His,Avitag (Cat. No. CD0-H82E5) captured on Biotin CAP-Series S Sensor Chip can bind Rituximab with an affinity constant of 1.73 nM as determined in a SPR assay (in presence of DDM and CHS) (Biacore T200) (QC tested).
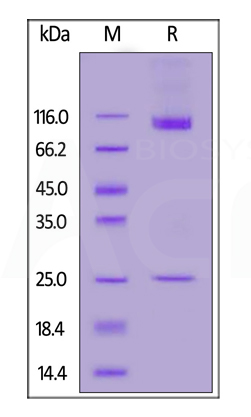
Human CD133 Full Length, His Tag (Nanodisc) (Cat. No. CD3-H52H1) on SDS-PAGE under reducing (R) condition. The gel was stained overnight with Coomassie Blue. The purity of the protein is greater than 90%.
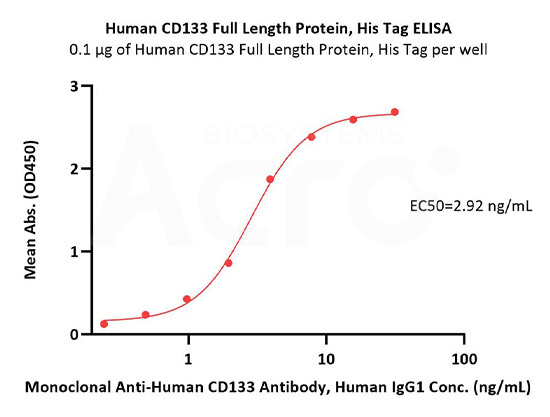
Immobilized Human CD133 Full Length Protein, His Tag (Cat. No. CD3-H52H1) at 1 μg/mL (100 μL/well) can bind Monoclonal Anti-Human CD133 Antibody, Human IgG1 with a linear range of 0.2-4 ng/mL (QC tested).

Authors: Lionel Rougé et al.
Journal: Science
Authors: Paige M. Glumac , Aaron M. LeBeau.
Journal: Glumac and LeBeau Clin Trans Med
Authors: Kenji Maeda, Debananda Das et al.
Journal: Journal of Biological Chemistry
Authors: Line Barington, Pia C. Rummel, et al.
Journal: Journal of Biological Chemistry
This web search service is supported by Google Inc.
