 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free! Get your ComboX free sample to test now!
Get your ComboX free sample to test now!
 Time Limited Offer: Welcome Gift for New Customers !
Time Limited Offer: Welcome Gift for New Customers !  Shipping Price Reduction for EU Regions
Shipping Price Reduction for EU Regions
> Vorgeformte Fibrillen (PFFs)--Ein neuartiger Ansatz zur Modellierung von Neurodegeneration
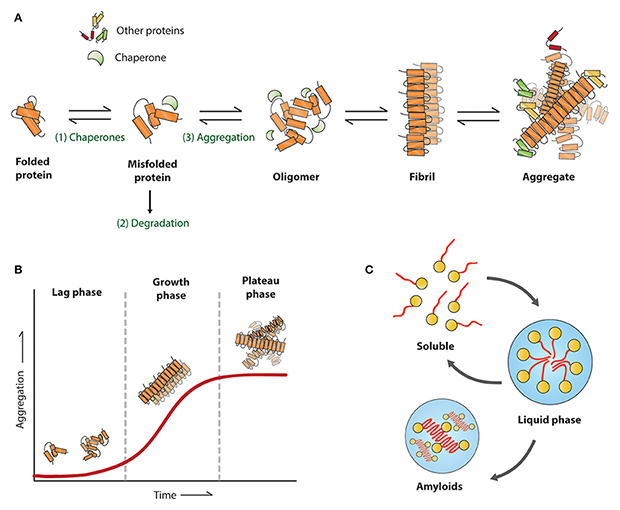
Die Proteinaggregation ist ein wesentliches pathologisches Merkmal neurodegenerativer Erkrankungen wie der Alzheimer-Krankheit (AD), der Parkinson-Krankheit (PD), der amyotrophen Lateralsklerose (ALS) und der Huntington-Krankheit (HD). Unter pathologischen Bedingungen schließen sich Tau, Amyloid beta, alpha-Synuclein, TDP-43, Huntingtin und andere Proteine zu einer Vielzahl unerwünschter Strukturen zusammen, die von Oligomeren und präfibrillären Anordnungen bis hin zu hochgradig strukturierten Anhäufungen reichen. Die fibrilläre Struktur stellt eine schnelle Wachstumsphase der Proteinaggregation dar, da diese Fibrillen "aktiv" sind und schnell Monomere für die Dehnung rekrutieren. Außerdem brechen diese Fibrillen nach dem Zufallsprinzip in kürzere Fragmente auf, die als "Samen" fungieren könnten, die auf andere Zellen übertragen werden und unabhängig voneinander Monomere zur Bildung neuer Fibrillen rekrutieren. Vorgeformte Fibrillen (Pre-formed fibrils, PFFs) sind in vitro gebildete aktive Fibrillen, die diese "Seeding"-Aktivität haben und in der Lage sind, kontinuierlich lösliche endogene pathologische Proteine zu rekrutieren, um Anhäufungen zu bilden und schließlich neurodegenerative Pathologien zu induzieren.
Die Entwicklung zuverlässiger Krankheitsmodelle ist von entscheidender Bedeutung für die Erforschung der pathologischen Mechanismen, für die Bewertung der Wirksamkeit therapeutischer Maßnahmen und die Beurteilung der Sicherheit von Arzneimittelkandidaten. Im Vergleich zu herkömmlichen Ansätzen der Krankheitsmodellierung hängt die durch PFFs induzierte Pathologie nicht von der Gen-Editierung oder von chemischen oder physikalischen Schäden ab und kann die natürlich vorkommenden pathologischen Prozesse besser nachahmen. Daher ist PFFs ein neuer Ansatz für die Modellierung neurodegenerativer Erkrankungen.
PFFs können aus Monomeren entweder durch Inkubation bei 37°C und Schütteln oder durch Heparininduktion erzeugt werden. Qualitätskontrolle und präzise Vorbereitung sind wichtig für erfolgreiche Experimente. Ein wichtiger Aspekt für die erfolgreiche Induktion von PFFs ist die Verwendung eines qualitativ hochwertigen Monomers mit hoher Reinheit, hoher Konzentration und korrekter Konformation. Da die PFFs in Zell- und Tierversuchen eingesetzt werden, ist die Kontrolle von Endotoxinen ebenfalls ein wichtiger Faktor. Darüber hinaus sollten die PFFs vor ihrer Verwendung mittels Ultraschall auf eine Länge von 50 nm oder kürzer gebracht werden, um die Rekrutierungsaktivität der PFFs zu gewährleisten und die Endozytose der PFFs zu erleichtern.
Die Morphologie und die Aktivität der PFFs konnten mit Hilfe des Elektronenmikroskops bzw. des Thioflavin T (ThT)-Fluoreszenztests überprüft werden. Erfolgreich induzierte PFFs zeigen unter dem Elektronenmikroskop eine Fibrillenstruktur. Der ThT-Test ist ein klassischer Test zum Nachweis von β-Sheet-Strukturen. Während PPFs Monomere rekrutieren, häufen sie immer mehr β-Sheet-Strukturen an. Wenn ThT an die β-Sheet-Struktur bindet, erhöht sich der Fluoreszenzwert, was die Aktivität der PFFs widerspiegelt.
Aneuro ist die Marke von ACROBiosystems, die sich auf den Bereich der Neurowissenschaften konzentriert. Aneuro bietet Tau-441-PFFs, Alpha-Synuclein-PFFs, Amyloid-Beta-PFFs, TDP-43-PFFs und SOD-1-PFFs an und unterstützt und beschleunigt damit die Entwicklung zuverlässiger neurodegenerativer Modelle.
| Molecule | Cat. No. | Product Description | Monomer Source | Expression System | Preorder/Order |
|---|---|---|---|---|---|
| Tau | TAU-H5115 | Human Tau-441/2N4R Pre-formed Fibrils Protein, Tag Free | TAU-H5117 | E.coli | |
| TAU-H5116 | Human Tau-441 K18 Pre-formed Fibrils Protein, Tag Free | NA | E.coli | ||
| TAU-H5113 | Human Tau-441 K18 (P301L) Pre-formed Fibrils Protein, Tag Free | TAU-H5118 | E.coli | ||
| Alpha-Synuclein | ALN-H5114 | Human Alpha-Synuclein (A53T) Pre-formed Fibrils Protein, Tag Free | ALN-H5116 | E.coli | |
| ALN-H5115 | Human Alpha-Synuclein Pre-formed Fibrils Protein, Tag Free | ALN-H5214 | E.coli |
Meanwhile, alpha-synuclein PFFs,Amyloid beta PFFs,TDP-43 PFFs,SOD-1 PFFs are under development. Nachricht schicken
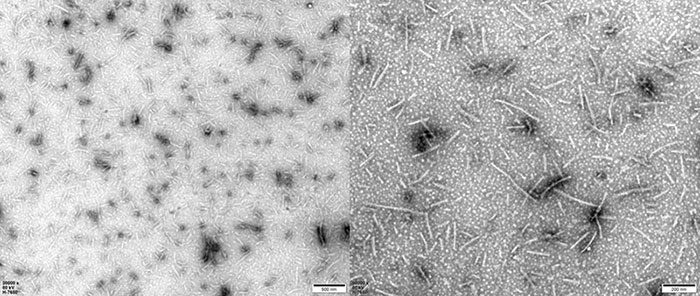
TEM of Human Tau-441/2N4R Pre-formed Fibrils Protein (Cat. No. TAU-H5115).
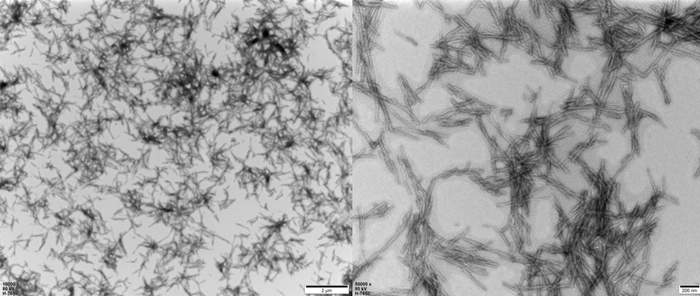
TEM of Human Tau-441 K18 (P301L) Pre-formed Fibrils Protein (Cat. No. TAU-H5113).
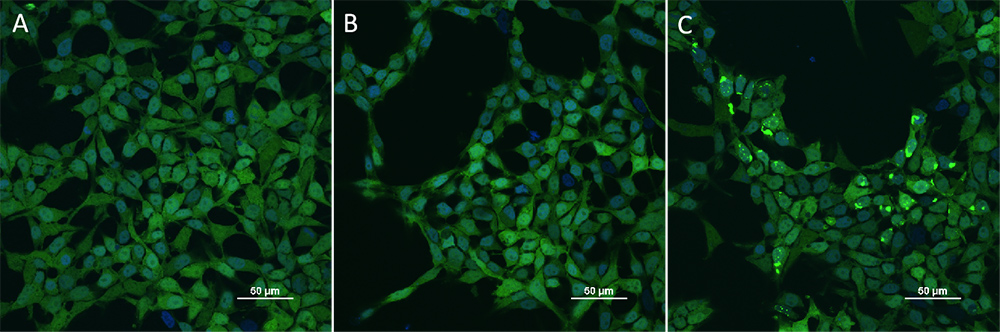
HEK293/Human Tau(GFP) Stable Cell Line were transduced with Human Tau-441 / 2N4R Pre-formed Fibrils Protein, Tag Free (ThT active) (Cat. No. TAU-H5115) and Human Tau-441 / 2N4R Protein, Tag Free (MALS verified) (Cat. No. TAU-H5117) respectively. The fluorescence of GFP-Tau (Green) and DAPI (Blue) were detected by confocal microscope. A. Lipo2000 transduction. B. Lipo2000 and Human Tau-441 / 2N4R Protein, Tag Free (MALS verified) transduction. C. Lipo2000 and Human Tau-441 / 2N4R Pre-formed Fibrils Protein, Tag Free (ThT active) transduction. Scale bars, 50 μm.
1. Stroo E, Koopman M, Nollen EA, Mata-Cabana A. Cellular Regulation of Amyloid Formation in Aging and Disease. Front Neurosci (2017). doi: 10.3389/fnins.2017.00064. PMID: 28261044; PMCID: PMC5306383.
2. Guo JL, Lee VM. Seeding of normal Tau by pathological Tau conformers drives pathogenesis of Alzheimer-like tangles. J Biol Chem (2011). doi: 10.1074/jbc.M110.209296. Epub 2011 Mar 3. PMID: 21372138; PMCID: PMC3083182.
This web search service is supported by Google Inc.
