Leave message
Can’t find what you’re looking for?
Fill out this form to inquire about our custom protein services!
Inquire about our Custom Services >>































 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free! Get your ComboX free sample to test now!
Get your ComboX free sample to test now!
 Time Limited Offer: Welcome Gift for New Customers !
Time Limited Offer: Welcome Gift for New Customers !  Shipping Price Reduction for EU Regions
Shipping Price Reduction for EU Regions
> Zytokine in GMP-Qualität
![]() Hergestellt und QC-geprüft unter GMP-Konformität
Hergestellt und QC-geprüft unter GMP-Konformität
![]() Entwickelt nach ISO 9001:2015 und ISO 13485:2016
Entwickelt nach ISO 9001:2015 und ISO 13485:2016
![]() Tierversuchsfreie Materialien
Tierversuchsfreie Materialien
![]() Materialien, die von zugelassenen Lieferanten bezogen werden
Materialien, die von zugelassenen Lieferanten bezogen werden
![]() ISO 5 Reinräume und automatische Abfüllanlagen
ISO 5 Reinräume und automatische Abfüllanlagen
![]() Qualifiziertes und gut geschultes Personal
Qualifiziertes und gut geschultes Personal
![]() Qualitätsbezogene Dokumente, die von der QA geprüft und genehmigt wurden
Qualitätsbezogene Dokumente, die von der QA geprüft und genehmigt wurden
![]() Vollständige Chargenproduktions- und Kontrollprotokolle
Vollständige Chargenproduktions- und Kontrollprotokolle
![]() Wartung und Kalibrierung der Ausrüstung
Wartung und Kalibrierung der Ausrüstung
![]() Validierung der analytischen Verfahren
Validierung der analytischen Verfahren
![]() Durchgeführte Stabilitätsstudien
Durchgeführte Stabilitätsstudien
![]() Umfassende regulatorische Unterlagen (RSF)
Umfassende regulatorische Unterlagen (RSF)


![]() SDS-PAGE>95%
SDS-PAGE>95%
![]() Endotoxingehalt weniger als 10 EU/mg
Endotoxingehalt weniger als 10 EU/mg
![]() Restgehalt an Wirtszell-DNA weniger als 0,02ng/μg
Restgehalt an Wirtszell-DNA weniger als 0,02ng/μg
![]() Restgehalt an Wirtszellproteinen weniger als 0,5ng/ug
Restgehalt an Wirtszellproteinen weniger als 0,5ng/ug
![]() Biologische Aktivität >0,8 x 107 IU/mg (Referenz der WHO Human IL-15 (NIBSC-Code: 90/530) als Standard)
Biologische Aktivität >0,8 x 107 IU/mg (Referenz der WHO Human IL-15 (NIBSC-Code: 90/530) als Standard)
![]() Mikrobielle Tests
Mikrobielle Tests
![]() Mykoplasmen-Tests
Mykoplasmen-Tests
![]() In-vitro-Virusuntersuchung
In-vitro-Virusuntersuchung
![]() Konsistenz von Charge zu Charge
Konsistenz von Charge zu Charge
![]() Umfassende Stabilitätsdaten verfügbar (beschleunigte, Einfrier/Auftau-, Langzeit- und Versandstabilitätsprüfung)
Umfassende Stabilitätsdaten verfügbar (beschleunigte, Einfrier/Auftau-, Langzeit- und Versandstabilitätsprüfung)
![]() Strenge Qualitätskontrollstandards
Strenge Qualitätskontrollstandards
- 16 Qualitätskontrollstandards.
- Ausgezeichnetes Sicherheitsprofil (Prüfung auf Sterilität, Mykoplasma, Endotoxin und Restverunreinigungen).
- Hohe Stabilität und Konsistenz von Charge zu Charge
![]() Qualitätsmanagementsystem nach GMP
Qualitätsmanagementsystem nach GMP
- ISO 5 Reinräume für die Abfüllung.
- Rohstoffe und Verpackungsmaterial sind registriert.
- Es stehen Möglichkeiten für Online- und Vor-Ort-Prüfungen zur Verfügung.
![]() Vorabgenehmigung zur Zulassung von biologischen Produkten
Vorabgenehmigung zur Zulassung von biologischen Produkten
- Ein umfassender Satz der regulatorischen Dokumente ist verfügbar.
- Validierungsberichte für Analysemethoden sind auf Anfrage erhältlich.
- FDA DMF filed.

Wir bei ACROBiosystems haben mehr als 5.000 rekombinante Proteinprodukte entwickelt und verfügen über mehr als 10 Jahre Erfahrung in der Entwicklung und Herstellung von Proteinen. Von der Gensynthese/Vektorkonstruktion bis zur Proteinexpression/Reinigung bieten wir alles aus einer Hand an. Dies umfasst alle Schritte vom Proteindesign über die Codon-Optimierung, die Gensynthese, die Aufreinigung bis hin zur Übertragung vom Labor auf die Großanlage. Verschiedene Expressionssysteme, Aufreinigungsmethoden und Protein-Tags/Markierungen können je nach Bedarf ausgewählt werden, um den Erfolg Ihrer Therapie zu maximieren.
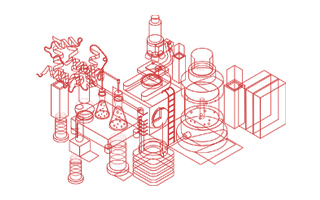
High purity than 90% of GMP Human IL-15
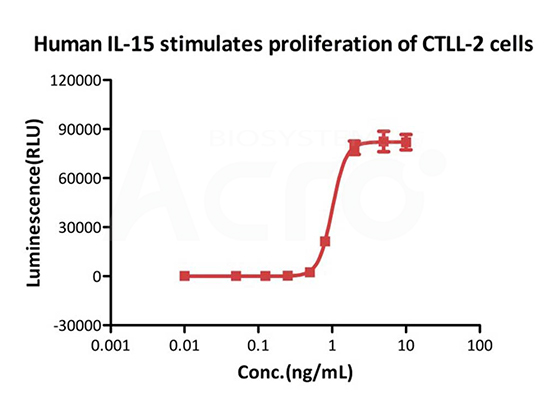
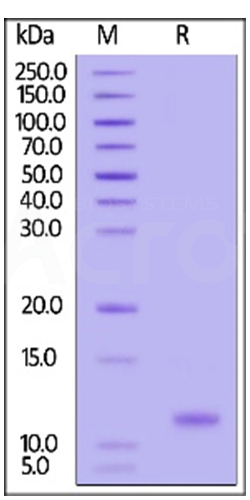
GMP Human IL-15 (Cat. No. GMP-L15H13) stimulates the proliferation of CTLL-2 cells. The EC50 for this effect is 1.004 ng/mL, corresponding to a specific activity of > 0.8ⅹ10^7 IU/mg, which is calibrated against human IL- 15 WHO International Standard (NIBSC code: 95/554).
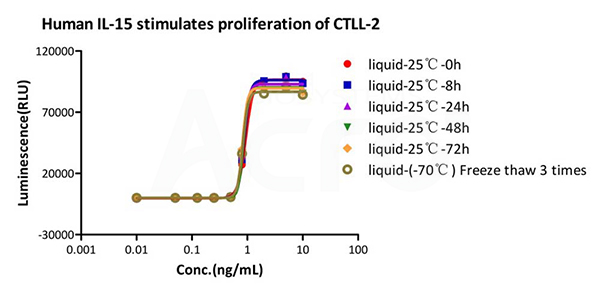
GMP Human IL-15 (GMP-L15H13) is stable in undiluted samples at 25℃ for 72 hours and freeze-thaw 3 times without performance reduction.
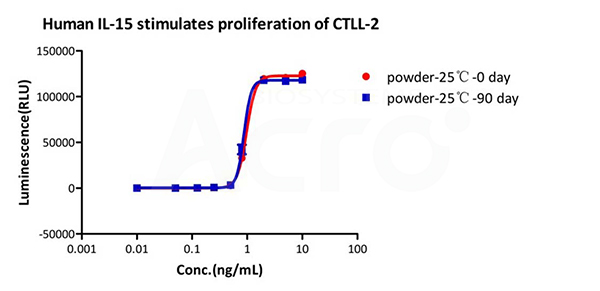
GMP Human IL-15 (GMP-L15H13) is stable in undiluted samples at 25 ℃ for 90 days without performance reduction performance reduction.
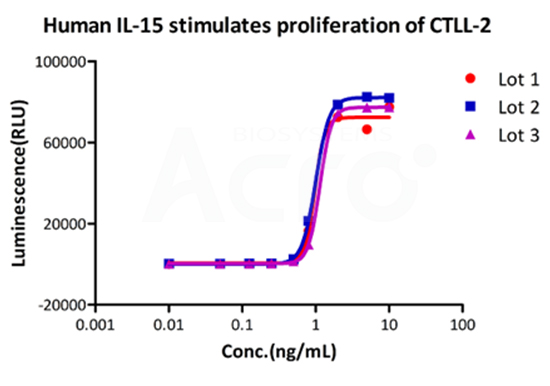
Bioactivity of three different lots of GMP Human IL-15 (GMP-L15H13) verified by cell-based assay, and the result shows very high batch-to-batch consistency.
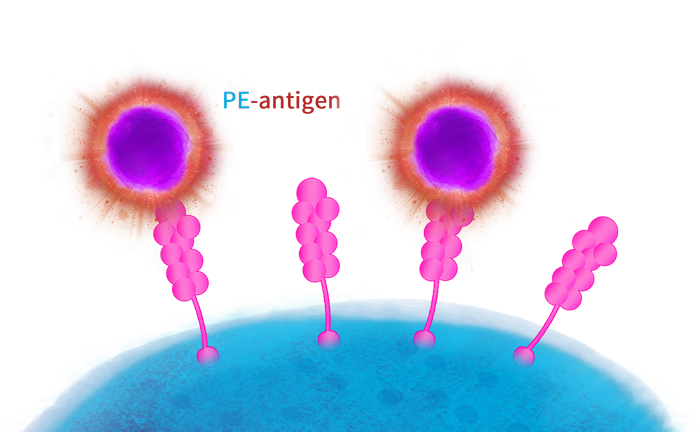
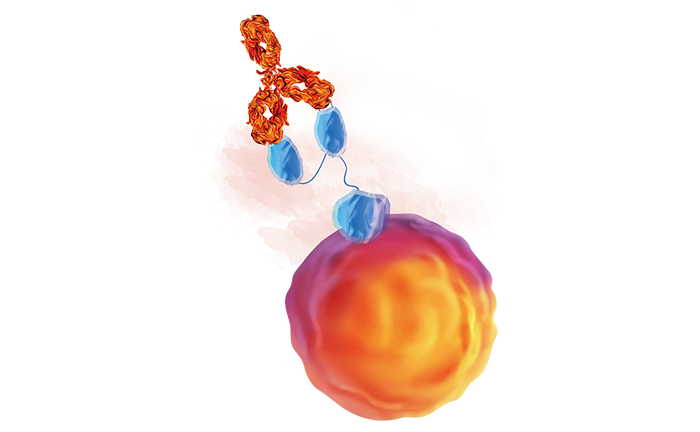
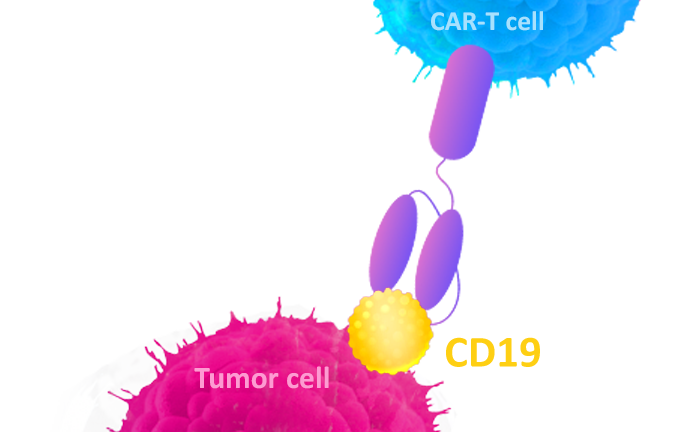
[1] Libby, Kendra A, and Xiaolei Su. Imaging Chimeric Antigen Receptor (CAR) Activation[J]. Methods in molecular biology. 2020, 153-160.
[2] Chinese Pharmacopoeia
[3] Corrected Draft Guidance for Industry: Chemistry, Manufacturing,and Control(CMC) Information for Human Gene Therapy Investigation New Durg Applications(INDs). FDA, CBER, 2018.7.20
This web search service is supported by Google Inc.