 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free! Get your ComboX free sample to test now!
Get your ComboX free sample to test now!
 Time Limited Offer: Welcome Gift for New Customers !
Time Limited Offer: Welcome Gift for New Customers !  Shipping Price Reduction for EU Regions
Shipping Price Reduction for EU Regions
> Zentrale Rohstoffe für die Zell- und Gentherapie
ACROBiosystems bietet eine breite Palette von Rohstoffen und Hilfsmitteln an, die für Zelltherapieprodukte benötigt werden, darunter Zytokine, Nukleasen und Aktivierungsperlen. Wir bieten verschiedene Materialqualitäten an, darunter sowohl Premium(Pre-GMP)- als auch GMP-Qualitäten. Unsere hochwertigen Proteine stammen aus demselben Klon, derselben Sequenz und demselben Expressionssystem wie unsere GMP-Produkte. Das bedeutet, dass Entwickler, die unsere hochwertigen Produkte verwenden, problemlos in GMP-Produkte für die Verwendung in CMC- oder klinischen Phasen übergehen können, ohne dass weitere Vergleichsstudien des Herstellungsprozesses erforderlich sind.
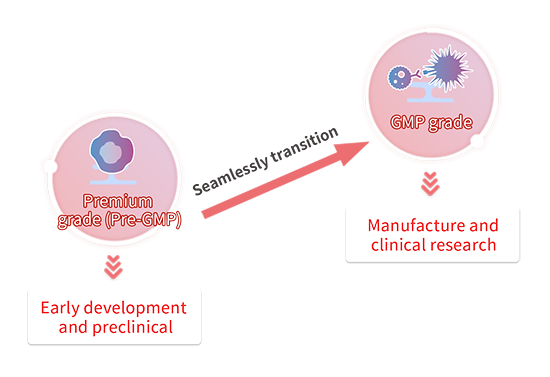
Um den Übergang Ihres Zelltherapieprodukts in die klinische Erprobung und darüber hinaus zu erleichtern, ist es entscheidend, eine das endgültige Ziel berücksichtigende Rohstoffstrategie zu entwickeln. Für die Forschung und Entwicklung von Zelltherapien im Frühstadium werden in der Regel Materialien verwendet, die nur für Forschungszwecke (RUO) verwendet werden. Wenn die Entwicklung jedoch in die vorklinische oder klinische Phase eintritt, erfüllen RUO-Materialien, die zuvor ausreichend gewesen sein mögen, nicht mehr die Kriterien, die für eine Weiterentwicklung erforderlich sind. Die meisten Strategien legen Wert darauf, so früh wie möglich die hochwertigsten verfügbaren Rohstoffe zu verwenden, was jedoch nicht immer möglich ist. Die Berücksichtigung von Materialübergängen kann dazu beitragen, Leistung und Kosten beim Übergang zur nächsten Stufe in Einklang zu bringen.
ACROBiosystems bietet verschiedene Materialqualitäten für unterschiedliche Entwicklungsstadien Ihres Zelltherapieprodukts an. Hochwertige Materialien werden im Rahmen unseres strengen Qualitätskontrollsystems hergestellt, das eine umfassende Reihe von Tests, einschließlich Sterilitäts- und Endotoxintests, umfasst. Die Produktleistung wird sorgfältig validiert und auf Kompatibilität für die Verwendung in Zellkulturen oder anderen Anwendungen im frühen vorklinischen Stadium getestet. Für den Übergang in spätere klinische Phasen bieten wir darüber hinaus einen kundenspezifischen GMP-Protein-Service an, der auf Ihre Bedürfnisse zugeschnitten ist. GMP-konforme Materialien werden auf der Grundlage unseres GMP-konformen Qualitätsmanagementsystems entwickelt. Diese Produkte werden nach strengen Qualitätsmanagement- und Freigabeteststandards hergestellt. Da unsere Premium(Pre-GMP)-Komponenten unseren GMP-Produkten ähnlich sind, kann der Übergang zwischen den Qualitäten ohne weitere Vergleichbarkeitsstudien problemlos erfolgen.
| Premium(Pre-GMP) Grade | GMP Grade | |
|---|---|---|
| Application | Research and Development; Preclinical research, seamless transition into clinical phases | Designed to meet clinical phase requirements and bolster your IND application to various regulatory bodies. |
| Quality System | ISO 9001 /ISO 13485 Certified | ISO 9001 /ISO 13485 Certified (Development stage) GMP Quality Management System (Production stage) |
| Production | ISO certified facilities | GMP certified facilities -by third-party audits |
| Transient or stable cell lines | Stable cell lines (Comprehensive external inspections) | |
| Animal-origin free materials or BSE/TSE free | Animal-origin free materials or BSE/TSE free | |
| Pharmaceutical-grade materials | Pharmaceutical-grade materials | |
| Strict 2 grade series sterile filtration | Strict 2 grade series sterile filtration | |
| Class 100 FFU | Class B+A cleanroom with automatic filling machine | |
| No additional virus clearance steps in | 2 additional virus removal and inactivation steps included (nanofiltration + low pH) | |
| Quality Control | Sterility / Mycoplasma testing | Sterility / Mycoplasma testing |
| Endotoxin control and detection | Endotoxin control and detection | |
| Validated key equipment and analytical instruments | Validated equipment /analytical instruments/analytical methods(analytical instruments audit trial) | |
| Residual DNA/HCP testing | Residual DNA/HCP testing | |
| Limited adventitious agent testing | Full adventitious agent testing (virus testing and animal in vivo safety experiments) | |
| Documentation | Common regulatory support | Comprehensive regulatory support files |
| DMF filing (Few products) | DMF filing (All products) |
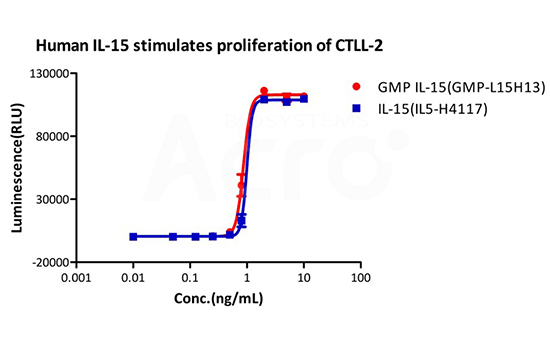
Recombinant Human IL-15 Protein premium grade (IL5-H4117), designed for preclinical stage, has the same activity and performance with GMP Grade IL-15 (GMP-L15H13), which enables a seamless transition from preclinical development to clinical phases .
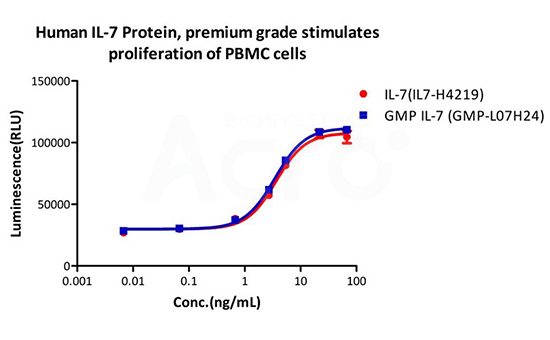
Human IL-7 Protein premium grade (IL7-H4219) designed for preclinical stage, has the same activity and performance with GMP Grade IL-7 (GMP-L07H24), which enables a seamless transition from preclinical development to clinical phases .
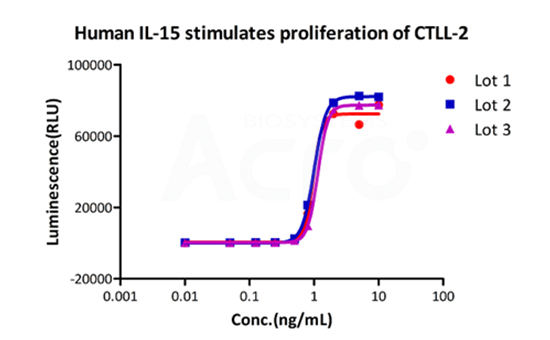
Bioactivity of three different lots of GMP Human IL-15 (GMP-L15H13) verified by cell-based assay, and the result shows very high batch-to-batch consistency.
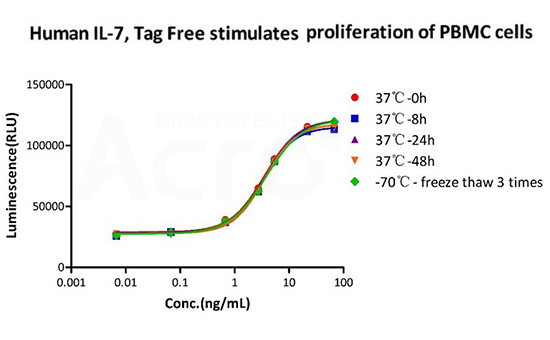
The Cell based assay shows that GMP Human IL-7 (GMP-L07H24) is stable at 37°C for 48 hours and after freezing and thawing 3 times.
This web search service is supported by Google Inc.
