Leave message
Can’t find what you’re looking for?
Fill out this form to inquire about our custom protein services!
Inquire about our Custom Services >>































 Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.  Limited Edition Golden Llama is here! Check out how you can get one.
Limited Edition Golden Llama is here! Check out how you can get one.
 Offering SPR-BLI Services - Proteins provided for free!
Offering SPR-BLI Services - Proteins provided for free! Get your ComboX free sample to test now!
Get your ComboX free sample to test now!
 Time Limited Offer: Welcome Gift for New Customers !
Time Limited Offer: Welcome Gift for New Customers !  Shipping Price Reduction for EU Regions
Shipping Price Reduction for EU Regions
> FcRn Neonataler Fc-Rezeptor

Lange Zeit war IgG die einzige Kategorie von Antikörpern, die aktiv von der Mutter auf ihre Nachkommen übertragen wird. Dies führt zu einer kurzfristigen passiven Immunität, wobei der spezifische IgG-Transport durch FcRn bewerkstelligt wird. 1972 identifizierten Jones et al. erstmals einen Rezeptor im Darm neugeborener Ratten, der mütterliches IgG an das Neugeborene weiterleitet, und nannten ihn dementsprechend Neonataler Fc-Rezeptor (FcRn). Die FcRn-Expression während der Schwangerschaft und Stillzeit spielt beim Transport von IgG über die Plazentaschranke und den Darmtrakt eine Rolle- Während des gesamten Lebenszyklus kann eine Vielzahl von Gewebezellen nachgewiesen werden. Die Hauptaufgabe besteht darin, den IgG- und Albuminspiegel im Serum aufrechtzuerhalten und die Verteilung im Gewebe zu regulieren.
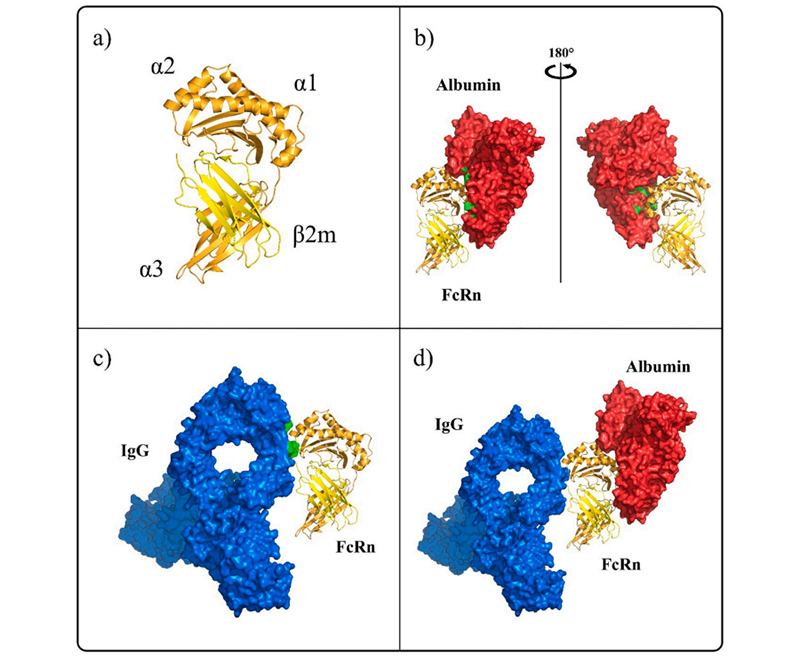 Human FcRn interaction with ligands IgG and albumin
Human FcRn interaction with ligands IgG and albuminFcRn ist ein Heterodimer, das aus zwei Untereinheiten, FCGRT und B2M, besteht. FCGRT hat drei extrazelluläre Funktionsbereiche, darunter drei lösliche Domänen (α1, α2 und α3), eine einzelne Transmembranhelix und einen zytoplasmatischen Schwanz (einige Studien haben gezeigt, dass der zytoplasmatische Schwanzbereich aus 44 Aminosäureresten besteht, die möglicherweise Signale enthalten, die intrazelluläre Wege vermitteln). Sein Molekulargewicht beträgt 40 bis 50 kDa, die sogenannte α-Kette, während das Molekulargewicht von B2M 14 kDa beträgt, die sogenannte β-Kette. Die beiden Ketten verbinden sich in Form von nicht-kovalenten Bindungen. FCGRT muss mit B2M zusammengebaut werden, um eine Transportfunktion zu übernehmen. Studien haben gezeigt, dass die Bindungsstelle von FcRn mit IgG und Serumalbumin nicht dieselbe ist, so dass die Bindung von FcRn an IgG nicht durch Serumalbumin beeinträchtigt wird.
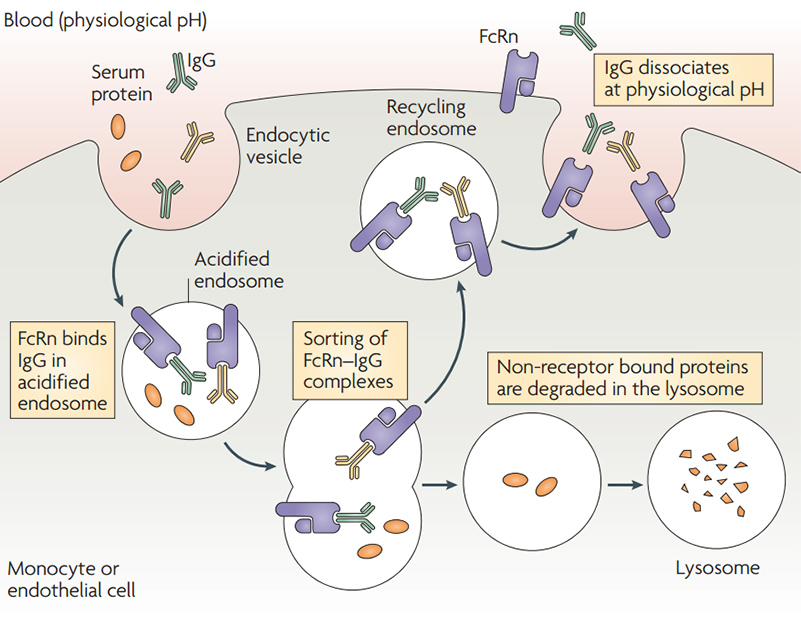 FcRn-mediated IgG and serum albumin recycling
FcRn-mediated IgG and serum albumin recycling![]() Expression durch HEK293-Zellen: zur Durchführung posttranslationaler Glykosylierung und anderer Modifikationen sowie zur korrekten Proteinfaltung
Expression durch HEK293-Zellen: zur Durchführung posttranslationaler Glykosylierung und anderer Modifikationen sowie zur korrekten Proteinfaltung
![]() Verschiedene Arten:Mensch, Maus, Rhesusaffe, Ratte, Schwein, Kaninchen, Katze, Rind, kann vollständig für verschiedene artenübergreifende Experimente verwendet werden
Verschiedene Arten:Mensch, Maus, Rhesusaffe, Ratte, Schwein, Kaninchen, Katze, Rind, kann vollständig für verschiedene artenübergreifende Experimente verwendet werden
| mehr als 95 %, bestätigt durch SDS-PAGE |
mehr als 90 %, bestätigt durch SEC-MALS |
![]() Geringes Endotoxin:<1.0 EU/µg
Geringes Endotoxin:<1.0 EU/µg
![]() Biotinylierte FcRn-Proteine, markiert mitAvitagTM sind verfügbar.Hohe Markierungseffizienz, die Markierungsstelle ist genau und eindeutig, was für ELISA/SPR/BLI-Nachweise auf der Grundlage der Bindung an Streptavidin im Prozess der Arzneimittelentwicklung und - optimierung geeignet ist
Biotinylierte FcRn-Proteine, markiert mitAvitagTM sind verfügbar.Hohe Markierungseffizienz, die Markierungsstelle ist genau und eindeutig, was für ELISA/SPR/BLI-Nachweise auf der Grundlage der Bindung an Streptavidin im Prozess der Arzneimittelentwicklung und - optimierung geeignet ist
![]() Affinität durch SPR & BLI bestätigt: hohe Bioaktivität garantiert, Verfahrensvorschriften kostenlos erhältlich
Affinität durch SPR & BLI bestätigt: hohe Bioaktivität garantiert, Verfahrensvorschriften kostenlos erhältlich
| Molekül | Kat. Nr. | Host | Produktbeschreibung | Struktur |
|---|
Authors: Jones EA, Waldmann TA.
Authors:Derry C. Roopenian, Shreeram Akilesh.
Authors:Imke Rudnik-Jansen, Kenneth A. Howard.
Authors: Karissa L. Gable, Jeffrey T. Guptill.
This web search service is supported by Google Inc.








